FÜR PATIENT:INNEN
Sehr geehrte PatientInnen,
mit den folgenden Inhalten möchten wir Ihnen Informationen rund um das Thema Brustkrebs und dessen Behandlung geben. Ebenso möchten wir Ihnen einige Informationen zur Möglichkeit der Teilnahme an Studien der WSG vermitteln.
Wir bitten um Ihr Verständnis dafür, dass wir keine Auskünfte zu medizinischen Behandlungen, Zweitmeinungen oder Einzelfällen am Telefon oder per E-Mail beantworten können. Gerne unterstützen wir Sie aber bei der Suche nach einem Studienzentrum in Ihrer Nähe und nennen Ihnen die ensprechende Klinik/Praxis, an die Sie sich für eine Studienteilnahme wenden können.
Welche Vorteile hat eine Teilnahme an einer klinischen Studie?
Als PantientIn einer klinischen Studie erhalten Sie ggf. Zugang zu neuesten Therapien, die in der Regelversorgung noch nicht verfügbar sind.
Als StudienteilnehmerIn können Sie ebenfalls von einer besonders engmaschigen und intensiven Betreuung profitieren.
Nicht zuletzt sind klinische Studien Voraussetzung für die weitere Verbesserung der Brustkrebstherapie. Mit einer Studienteilnahme können Sie dazu beitragen, Erkenntnisse über mögliche Therapien für die Zukunft zu schaffen.
Wo finde ich ein Studienzentrum in meiner Nähe?
Wenn Sie sich für die Teilnahme an einer klinischen Studie interessieren vermitteln wir Ihnen gerne den Kontakt zu einem der mit uns kooperierenden Brustzentren. Im Gespräch mit dem Arzt vor Ort können Sie mehr über für Sie relevante Studien erfahren und klären, ob in Ihrem konkreten Fall eine Teilnahme möglich ist.
Was ist Brustkrebs?
- Ca. 70.000 Frauen (und ca. 710 Männer) erkranken in Deutschland jährlich neu an Brustkrebs, genauer: an einem invasiven Mammakarzinom.
- 6.000 Frauen zusätzlich sehen sich jährlich mit der Diagnose eines In-situ-Mammakarzinoms (Krebsvorstufe) konfrontiert.
- Biologisch werden invasive Mammakarzinome in fünf Subtypen unterteilt, die unterschiedlich zu therapieren sind.
- In den letzten Jahren ist es gelungen, für die einzelnen Brustkrebsarten immer zielgerichtetere Therapieverfahren zu entwickeln.
- Nach wie vor kann aber in den meisten Fällen auf eine anstrengende und nebenwirkungsträchtige Chemotherapie nicht verzichtet werden.
- Bei etwa 50-60 % der jährlich neu diagnostizierten Brustkrebspatientinnen ist nicht genau klar, ob sie von einer Chemotherapie zusätzlich zur Antihormontherapie profitieren oder nicht.
- Die Westdeutsche Studiengruppe (WSG) erforscht seit mehr als 30 Jahren nach Instrumenten, mit denen für die einzelne Patientin eine passgenaue und möglichst nebenwirkungsarme Therapie festgelegt werden kann.
Weitere Informationen
Prinzipien der Brustkrebstherapie
- Wenn die Voruntersuchungen mit bildgebenden Verfahren (Ultraschall, Mammographie, Kernspintomographie) den Verdacht auf Brustkrebs nahelegen, wird eine Gewebeprobe entnommen, fachsprachlich: eine Biopsie durchgeführt.
- Die Gewebeprobe wird unter dem Mikroskop und mit speziellen Verfahren genau untersucht. Das Ergebnis gibt Auskunft darüber, welcher Brustkrebstyp vorliegt und wie schnell er wächst.
- Auf Grundlage dieser Erkenntnisse wird ein Therapieplan erstellt. Soll noch vor der Operation medikamentös behandelt werden? Wann kann die Operation stattfinden, und wie geht es danach weiter? Hat die Patientin Aussicht auf Heilung oder geht es in erster Linie um Sicherung der Lebensqualität?
- Neoadjuvante Therapie: Medikamentöse Therapie vor der Operation. Bei bestimmten Brustkrebsarten gelingt es, das Karzinom damit schon vor der Operation zu verkleinern. Dies kann sich positiv auf die Operabilität auswirken und den Anteil brusterhaltender Operationen steigern.
- Operation: Ziel ist die komplette Entfernung des Karzinoms. Wenn die Größenverhältnisse es erlauben, das Karzinom also im Vergleich zur Brust noch nicht zu groß ist, gelingt das mit einem brusterhaltenden Eingriff. Bei ungefähr 30 Prozent der Brustkrebspatientinnen ist das nicht der Fall, bei ihnen ist eine operative Entfernung der Brust notwendig, eine Mastektomie.
- Strahlentherapie: Sie kommt nach einer brusterhaltenden Operation zum Einsatz. Durch die Bestrahlung wird das Erbgut von Zellen so sehr geschädigt, dass sie zur Teilung nicht mehr in der Lage sind und absterben. Gesunde Zellen sind in der Lage, solche Strahlenschäden bis zu einem gewissen Maß zu reparieren, Tumorzellen nicht. Darauf beruht die Wirkung der Strahlentherapie gegen Tumorzellen.
- Adjuvante Therapie: Medikamentöse Therapie nach der Operation. Je nach Brustkrebstyp kommt eine Antihormontherapie, eine Chemotherapie, eine Antikörpertherapie, eine Im-muntherapie oder auch eine Kombination aus diesen Medikamentenklassen zum Einsatz.
- Palliative Therapie: Wenn Brustkrebs gestreut hat, Tumorzellen also in andere Organe gewandert sind, sinken zwar die Chancen auf Heilung rapide. Betroffene Frauen leben aber durchaus noch viele Jahre. Das Therapieziel verschiebt sich von der Heilung in Richtung eines Lebens mit der Erkrankung. Die Erhaltung der Lebensqualität hat dann höchste Priorität. Zur Behandlung werden unterschiedliche Medikamentenklassen eingesetzt.
- Supportivtherapie: In allen Phasen einer Erkrankung benötigen Patientinnen Unterstüt-zung. Zwei Ziele sind wesentlich: Zum einen die Stärkung der Patientin, damit sie die wirk-samen, aber häufig anstrengenden und nebenwirkungsreichen Therapien gut übersteht. Zum anderen die Unterstützung der Patientin und gegebenenfalls ihres Umfelds bei der Bewältigung der Erkrankung: Psychoonkologie, Bewegungstherapie und ausgewählte kom-plementärmedizinische Verfahren kommen dabei unter anderem zum Einsatz.
So wirken Medikamente gegen Brustkrebs
- Eine Krebstherapie ist umso aussichtsreicher, je zielgenauer sie durchgeführt wird. Aus diesem Grund ist es sinnvoll, einen Tumor chirurgisch möglichst komplett zu entfernen oder ihn mit einer Strahlentherapie anzugehen. Mit diesen Verfahren wird der Tumor an Ort und Stelle, also lokal, therapiert.
- Brustkrebs ist aber in den meisten Fällen keine rein lokale Erkrankung. Es kann dazu kommen, dass einzelne Krebszellen bereits vor der Diagnose aus der Brust in den Körper gelangen (Mikrometastasen). Die systemische Therapie ist daher sehr wichtig. Medikamente gegen Krebs gelangen über eine Infusion ins Blut oder als Tablette in den Verdauungstrakt. Letztlich gelangen sie damit über das Blut in alle Gewebe des Körpers. Medikamente wirken nicht lokal, sondern systemisch.
- Obwohl Medikamente prinzipiell systemisch wirken, gibt es Unterschiede hinsichtlich ihrer Zielgenauigkeit. Manche Substanzen „erkennen“ bestimmte Strukturen, die vorzugsweise auf Tumorzellen vorkommen und wirken damit zielgenauer als andere, sprich: sie wirken besser gegen den Tumor und haben weniger Nebenwirkungen auf gesunde Zellen.
- Vereinfacht betrachtet lassen sich die heute eingesetzten Krebsmedikamente in drei Klassen einteilen:
1. Medikamente zur Hemmung der Zellteilung
2. Medikamente, die bestimmte wachstumsfördernde Signale ausschalten
3. Medikamente, die gezielt das körpereigene Immunsystem aktivieren. - Medikamente zur Hemmung der Zellteilung: Wenn es gelingt, mit einem Medikament vorzugsweise sich schnell teilende Zellen zu schädigen, dann ist die Wahrscheinlichkeit hoch, dass damit in erster Linie Krebszellen bekämpft werden; denn die enorme Zellteilungsgeschwindigkeit ist ein Merkmal vieler Krebszellen.
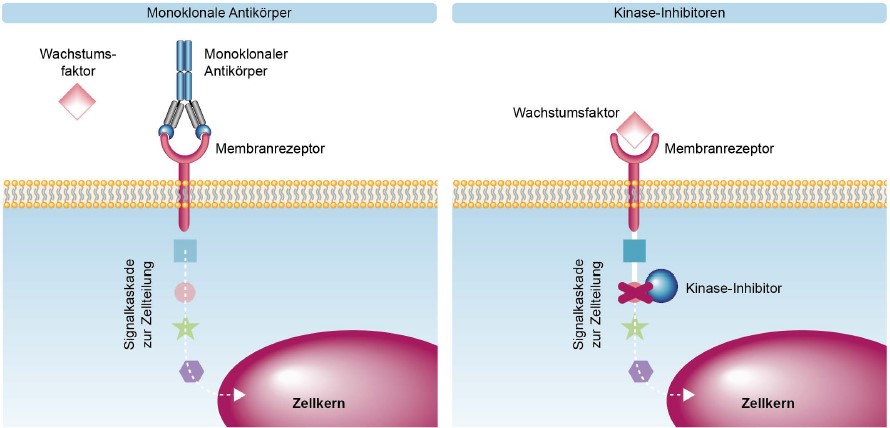
- Medikamente, die bestimmte wachstumsfördernde Signale ausschalten: Viele Krebszellen haben an ihrer Oberfläche Bindungsstellen für bestimmte Hormone oder andere Wachstumsfaktoren. Sobald sie an diese Bindungsstellen „andocken“, entsteht ein Signal, das von der Außenseite bis in den Zellkern gelangt und dort den Impuls zur Zellteilung gibt. Das ursprüngliche Signal lässt sich auf zwei Wegen blockieren: Durch Blockade der Bindungsstelle an der Zellaußenseite oder durch Unterbrechung des Signalwegs im Zellinneren.
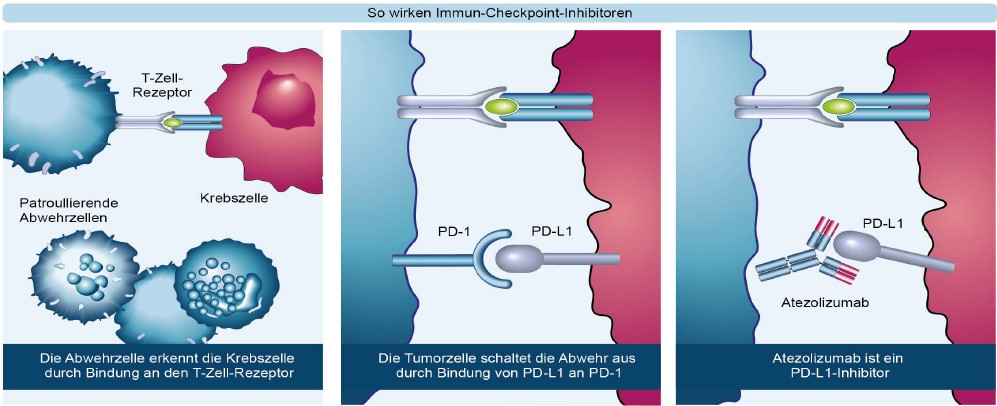
- Medikamente zur gezielten Aktivierung des Immunsystems: Viele Krebszellen können auf spezialisierten Immunzellen sozusagen einen Schalter umlegen, wodurch die Abwehrzelle lahmgelegt wird. Der Tumor tritt gewissermaßen auf die Abwehrbremse. Vergleichsweise neue Medikamente können diese Abwehrbremse lösen, im Kampf gegen den Krebs also das körpereigene Immunsystem aktivieren.
Weitere Informationen
Das ADAPT-Studienkonzept
- ADAPT untersucht die Möglichkeiten der Therapie-Optimierung/De-Eskalation der Brustkrebstherapie in allen Subtypen. Die beiden Säulen der Entscheidungsfindung sind
a. die Untersuchung eines möglichen frühen Ansprechens des Tumors auf eine medikamentöse Therapie und
b. die Verwendung moderner molekularer Marker - Das ADAPT-Prinzip bedeutet demnach: Zusätzlich zur Berücksichtigung der klassischen Risikofaktoren – und gegebenenfalls des genomischen Risikos bei der Diagnosestellung – wird das frühe Ansprechen des Tumors auf eine erste, präoperative medikamentöse Therapie als wichtige Information zur weiteren Therapie-Entscheidung untersucht.